25
2023
-
09
体外诊断试剂申报资料说明书/标签的提交要求
分类:
行业新闻
国家在持续加强对医疗器械的注册管理,对我们申请人所提交的材料要求是“材料齐全、符合法定形式要求的”。那今天,我们和大家来谈谈体外诊断试剂申报资料中的说明书/标签材料的提交要求。
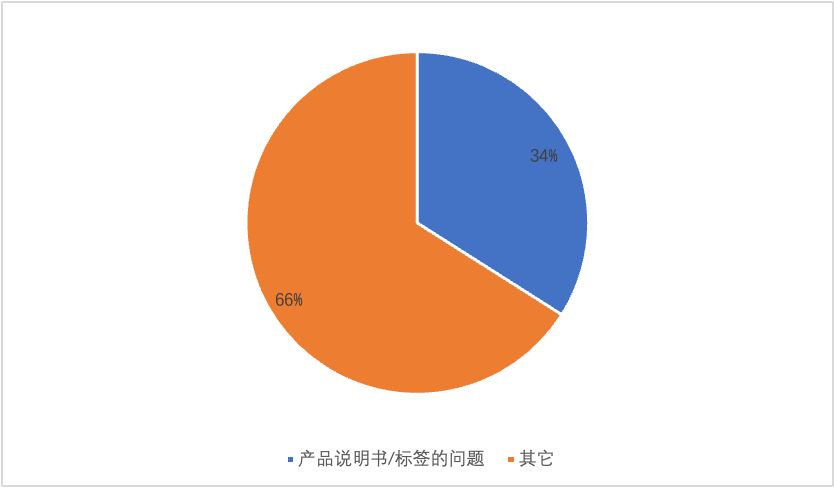
根据福建省公布的2019-2021年间,对第二类体外诊断试剂产品首次注册申报资料的缺陷项目统计中,产品说明书/标签的问题占比34%,占据缺陷项目统计中的首位。
1. 体外诊断试剂说明书:
在2021年9月,国家药监局发布的《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》的附件4《体外诊断试剂注册申报资料要求及说明》中,关于产品说明书和标签样稿的要求如下:

根据要求,体外诊断试剂的产品说明书,需要符合《体外诊断试剂说明书编写指导原则》,现行的指导原则是2014年版,在该指导原则对体外诊断试剂产品说明书编写的格式及各项内容的撰写进行了详细的说明,为我们编写体外诊断试剂产品说明书提供了原则性指导和参考。

其中,体外诊断试剂说明书格式要求如下:
××××(产品通用名称)说明书
【产品名称】
【包装规格】
【预期用途】
【检验原理】
【主要组成成分】
【储存条件及有效期】
【适用仪器】
【样本要求】
【检验方法】
【阳性判断值或者参考区间】
【检验结果的解释】
【检验方法的局限性】
【产品性能指标】
【注意事项】
【参考文献】
【注册人】(或者【备案人】)
【医疗器械注册证编号】(或者【医疗器械备案凭证编号】)
【生产企业】
【医疗器械生产企业许可证编号】(或者【医疗器械生产备案凭证编号】)
【说明书批准及修改日期】
2.标签:
标签样稿的内容应当符合《医疗器械说明书和标签管理规定》,当前实施的版本是2014年7月国家药监局发布的:

《医疗器械说明书和标签管理规定》中第十三条,对标签中应包含的一般内容进行了详细规定,并在最后提到:“医疗器械标签因位置或者大小受限而无法全部标明上述内容的,至少应当标注产品名称、型号、规格、生产日期和使用期限或者失效日期,并在标签中明确‘其他内容详见说明书’。“
同时在《医疗器械说明书和标签管理规定》中第十四条中,对产品说明书和标签不得有的内容,进行了详细说明:

上一篇
相关新闻



